La angiogénesis en los tumores cerebrales
El glioblastoma multiforme es la forma más maligna de un tumor cerebral. Suele mostrar características de rápida invasión y vascularización masiva. A pesar de los modernos avances en cirugía, radioterapia y quimioterapia, los pacientes normalmente sobreviven sólo 12 a 15 meses después del diagnóstico. Por lo tanto, todavía hay una necesidad urgente de encontrar terapias alternativas y más eficaces.
Las células tumorales dependen de la vasculatura para acceder a los nutrientes y el oxígeno. Considerando el medio ambiente altamente vascularizado del glioblastoma, la terapia antiangiogénica, en combinación con la quimioterapia estándar, podría resultar beneficiosa para la curación o estabilización de la enfermedad. Se sabe que las células endoteliales cerebrales asociadas al tumor presentan propiedades funcionales y fenotípicas únicas que no son compartidas por las células endoteliales cerebrales normales. Estos rasgos distintivos de la vasculatura del glioma deberían ser considerados para el desarrollo de fármacos antiangiogénicos.
Angiogénesis en el glioblastoma
El glioblastoma multiforme es el tumor cerebral maligno más común en los adultos. La supervivencia media libre de progresión es de poco más de 6 meses después de la resección quirúrgica, quimioterapia y radiación, seguido invariablemente de recidiva tumoral. La resección quirúrgica agresiva disminuye la carga de células tumorales en un 99%, dejando aproximadamente 100 millones de células, y la terapia adyuvante con un agente citotóxico como la temozolomida reduce la carga a 10 millones de células. Así, la supervivencia global media conseguida con la cirugía o irradiación o con quimioterapia de rescate sigue siendo sólo de 14,6 meses.
¿Cómo se explica este mal pronóstico? En el examen de los bordes, el tejido cerebral por lo demás normal al momento del diagnóstico revela uniformemente la presencia de células infiltrantes de glioma. Por otra parte, las células de glioma que son resistentes a los efectos de la quimioterapia y la radiación participan en la progresión tumoral. Las recientes investigaciones se han centrado en dos conceptos aparentemente no relacionados. En primer lugar, las interacciones entre las células tumorales y los vasos sanguíneos parecen facilitar el crecimiento del cáncer. En efecto, un inhibidor de la angiogénesis, el bevacizumab, ha demostrado elevar la supervivencia libre de progresión en individuos con diagnóstico reciente o recurrente de glioblastoma multiforme, presumiblemente mediante la inhibición de la formación de vasos dependientes del factor de crecimiento endotelial vascular (VEGF) y de la permeabilidad vascular en tumores altamente vasculares. En segundo lugar, muchos tipos de cáncer, incluyendo el glioblastoma multiforme, parecen accionarse por una sub-población de células madre del cáncer. Varios atributos distinguen a las células madre de glioma de otras células de glioma, incluyendo la capacidad de auto-renovación y la generación de tumores después de los xenotrasplantes. Las células madre de glioma poseen propiedades que las hacen resistentes a la radiación y quimioterapia, y pueden servir como un repositorio para el glioblastoma multiforme, permitiendo la recurrencia. Varios estudios han rescatado estos conceptos.
Una característica patológica del glioblastoma multiforme que lo distingue de los tumores gliales de bajo grado es la proliferación microvascular. Varios mecanismos están implicados en la formación de los vasos sanguíneos en estos tumores (fig. 1). Uno de ellos, es el surgimiento de capilares a partir de vasos sanguíneos preexistentes por medio de la proliferación endotelial, que parece depender de la hipoxia en el núcleo del tumor. De hecho, el factor inducible por hipoxia, que aumenta la transcripción de VEGF, se activa en el glioblastoma multiforme. Otro mecanismo de formación de nuevos vasos sanguíneos es la liberación de factores angiogénicos de células tumorales. Éstas reclutan factores que pueden participar en la formación de vasos.
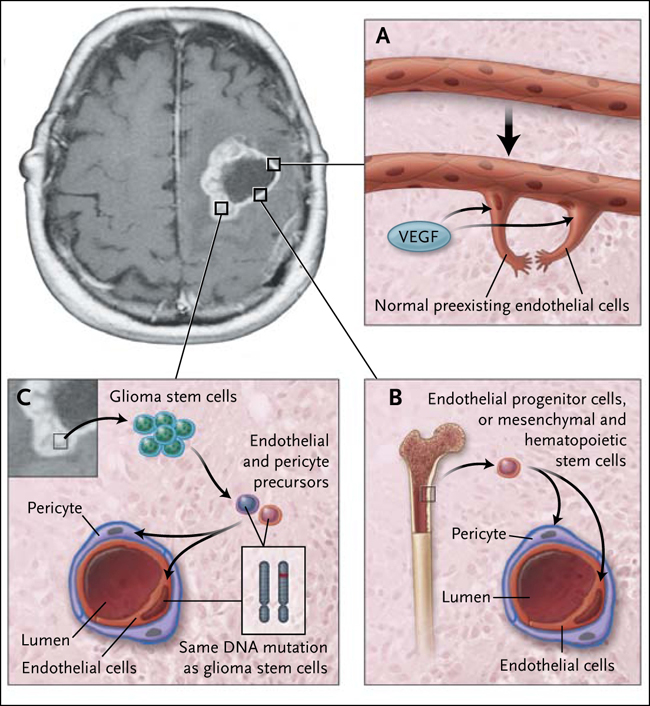
Figura 1: la angiogénesis en el glioblastoma multiforme
Se han descrito varias vías para la formación de nuevos vasos sanguíneos en el glioblastoma multiforme. Las células tumorales hipóxicas, especialmente aquellas que rodean el núcleo necrótico, liberan factores de crecimiento vasculares, como el factor de crecimiento endotelial vascular (VEGF), estimulando la formación de nuevos vasos sanguíneos a partir de células endoteliales normales (panel A) preexistentes. Este proceso implica la proliferación de células endoteliales y una mejor permeabilidad vascular. La nueva formación de vasos sanguíneos también se produce a través de la médula ósea derivada de las células progenitoras endoteliales o a través de las células madre mesenquimales o hematopoyéticas (panel B). Estas unidades migran de la circulación sistémica hacia el interior de los tumores. Las últimas investigaciones demuestran que las células madre de glioma contribuyen a la formación de vasos sanguíneos tumorales mediante la diferenciación a células endoteliales, pericitos o células contráctiles que se posicionan alrededor de las células endoteliales de los vasos sanguíneos más pequeños (panel C). En el cerebro normal, la unidad neurovascular se compone de neuronas, astrocitos, células endoteliales y pericitos. Estos últimos juegan un papel crítico en la regulación de la función de los vasos sanguíneos: controlan el flujo sanguíneo local y la permeabilidad de la barrera hematoencefálica y se comunican directamente con las células endoteliales a través de uniones comunicantes y señales paracrinas.
Los trabajos de cuatro grupos independientes han puesto de manifiesto que las células madre de glioma pueden contribuir a la formación de vasos sanguíneos en los tumores mediante la diferenciación de células endoteliales o pericitos, un fenómeno denominado mimetismo vascular. Esto es importante porque indica que la progenie de las células madre de un glioma no se limita a un linaje de unidades neuroepiteliales. Utilizando muestras quirúrgicas de humanos, Rong Wang y colaboradores (Nature 2010; 468:829-33) y Lucia Ricci-Vitiani y colegas (Nature 2010; 468:824-8) encontraron que un subconjunto de células endoteliales que recubrían los vasos tumorales llevaban las mismas anomalías genéticas (por ejemplo, la amplificación del receptor del factor de crecimiento epidérmico [EGFR] o mutación TP53) que las células tumorales malignas adyacentes. Al usar células tumorales muy disociadas, los dos grupos de investigación también observaron la presencia de una población de células neoplásicas progenitoras endoteliales in vivo, y demostraron in vitro que una sub-población de células madre de glioma daba lugar a células endoteliales. Estas unidades, cuando se trasplantan por vía intracraneal en ratones inmunocomprometidos, da lugar a tumores en los que una parte de las células endoteliales que contribuyen a los vasos sanguíneos se originan a partir de los trasplantados células de glioma humano en lugar de los de ratones. Utilizando un modelo de ratón de glioblastoma multiforme, Yasushi Soda y colaboradores (Proc Natl Acad Sci U S A 2011; 108:4274-80) observaron una sub-población de células endoteliales dentro de estos tumores que expresaban antígenos específicos de células endoteliales y antígenos específicos de tumores. Todos los grupos concluyeron que las unidades endoteliales derivadas de tumores son más frecuentes en el núcleo del glioblastoma multiforme y se encuentran con menos frecuencia en la periferia del tumor.
Un reciente informe proporciona una fuerte evidencia que las células madre de glioma también generan pericitos vasculares que rodean los vasos sanguíneos dentro de glioblastoma multiforme. Se ha observado que las células madre de glioma son capaces de formar pericitos vasculares in vitro y que las células madre de glioma pueden dar lugar a los pericitos en modelos de xenoinjerto de ratón in vivo. Además, la mayoría de los pericitos tumorales llevan las mismas alteraciones genéticas que se encuentran en el glioblastoma multiforme. Sorprendentemente, también se descubrieron pericitos neoplásicas en el cerebro normal peritumoral. Estos resultados tienen implicaciones importantes para el tratamiento del glioblastoma: el aumento de pericitos podría conferir resistencia a bevacizumab y ser una consecuencia de la profunda hipoxia que acompaña el bloqueo de VEGF.
Tales resultados han proporcionado una comprensión más amplia de cómo se forman los vasos sanguíneos dentro del glioblastoma multiforme. En estos tumores, los propios vasos sanguíneos son, al menos en parte, neoplásicos. Queda por definir en qué medida el mimetismo vascular en el glioblastoma multiforme se traduce en una generación de células endoteliales derivadas de células madre del glioma en lugar de pericitos. También existen otras preguntas claves. ¿Cuál es el significado funcional del mimetismo vascular con respecto al microambiente de las células madre de glioma? ¿Este fenómeno es común en todos los tumores de tipo glioblastoma multiforme, o representa un subtipo de glioblastoma multiforme? Por último, ¿cómo los vasos tumorales derivados del mimetismo vascular difieren de los derivados de sus homólogos no neoplásicos? El trabajo colectivo de estos investigadores apunta al uso de la angiogénesis celular para nuevos enfoques experimentales en el tratamiento del glioblastoma multiforme. De hecho, la interrupción de mimetismo vascular, ya sea a través de la orientación específica de células endoteliales derivadas del tumor o por vía de los pericitos, ralentiza el crecimiento del tumor.
Fuente bibliográfica
Angiogenesis in Glioblastoma
Sunit Das, M.D., Ph.D., and Philip A. Marsden, M.D.
Keenan Research Centre of the Li Ka Shing Knowledge Institute and the Departments of Neurosurgery and Medicine, St. Michael’s Hospital (S.D.), and the University of Toronto (P.A.M.) — both in Toronto.
DOI: 10.1056/NEJMcibr1309402