Conjugado péptido-fármaco dirigido a HER2 con mayor penetrabilidad para cáncer de mama
Presentan ventajas como la especificidad de la diana, un amplio índice terapéutico y una vida media en circulación prolongada.
La quimioterapia basada en agentes citotóxicos constituye la base del tratamiento anticanceroso tradicional y se utiliza ampliamente para tratar una amplia gama de tipos de cáncer. Sin embargo, la toxicidad no selectiva de los agentes quimioterapéuticos conduce a una eficacia reducida, toxicidad sistémica, resistencia a los fármacos y una ventana terapéutica estrecha, lo que ha puesto de relieve la necesidad y ha impulsado el desarrollo de nuevas estrategias para una administración más eficaz y segura de fármacos moleculares pequeños. Los sistemas de administración dirigida están diseñados para dirigir agentes tóxicos a zonas tumorales mediante receptores específicos de la superficie del tumor. Este enfoque se remonta a principios del siglo XX, cuando Paul Ehrlich, el fundador de la quimioterapia, creó el "concepto de bala mágica", según el cual los fármacos se dirigen directamente a los objetivos estructurales celulares previstos, sin afectar a los objetivos secundarios. Posteriormente, se desarrolló una nueva categoría de medicamentos (conjugados anticuerpo-fármaco [ADC]).
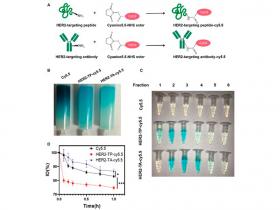
Para abordar el problema del tamaño de los ADC en la administración dirigida de fármacos, investigadores de la Universidad de Sun Yat-Sen, China desarrollaron un conjugado de péptido-mertansina dirigido a HER2 (HER2-TPMC) y realizaron una comparación directa con el conjugado de anticuerpo-mertansina dirigido a HER2 (HER2-TAMC) como posible alternativa para la terapéutica del cáncer de mama de alta penetración.
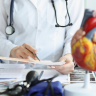
Como era de esperar, un ensayo farmacocinético (PK) reveló que HER2-TP tenía niveles más bajos persistentes en la circulación después de 1 hora (∼75%) en comparación con el 85% del anticuerpo dirigido a HER2 (HER2-TA). El efecto citotóxico celular fue similar en HER2-TPMC y HER2-TAMC en la línea celular de cáncer de mama HER2+ BT474, demostrando así una bioactividad similar de ambos conjugados. HER2-TPMC no sólo reveló una mayor captación y especificidad en cultivos in vitro de esferoides 3D en comparación con el fármaco parental, la mertansina, sino que también tuvo una retención significativa en los esferoides.
Este hallazgo contrastó fuertemente con HER2-TAMC, un conjugado de gran tamaño que no fue capaz de penetrar la barrera de los esferoides. La captación tumoral in vivo en un modelo ortotópico BT474 indicó una mayor captación en comparación con el fármaco parental y HER2-TAMC.
Los autores desarrollaron con éxito un conjugado péptido-mertansina dirigido a HER2 con captación celular específica que dio lugar a tiempos de retención más prolongados in vitro e in vivo. HER2-TPMC (∼5 kDa de tamaño) mostró una rápida penetración tisular y una mayor captación y retención tumoral in vitro e in vivo. Por lo tanto, HER2-TPMC es una alternativa razonable para la quimioterapia del cáncer HER2-positivo.