Transferencia de genes para la enfermedad muscular
La terapia génica para trastornos que afectan los músculos, como la distrofia muscular de Duchenne y la miopatía miotubular, ha sido un constante desafío, en gran parte debido a la dificultad de administrar el gen terapéutico a las células dentro del tejido muscular.
La genoterapia es un enfoque prometedor para el tratamiento de numerosas enfermedades. Es un método seguro y efectivo para la entrega de genes a los tejidos apropiados. Lograr esto es un desafío especialmente difícil en pacientes con trastornos neuromusculares, como las distrofias musculares, ya que aproximadamente el 40% de la masa corporal consiste en tejido muscular. El descubrimiento de que los vectores de transferencia de genes, derivados de virus adenoasociados (AAV, por sus siglas en inglés) pueden administrar sistemáticamente genes al músculo en todo el cuerpo, representa un punto de inflexión. Sin embargo, recientes ensayos clínicos indican que las altas dosis de vectores AAV necesarias (>10:14 partículas de vectores por kilogramo de peso corporal) pueden a veces dar lugar a efectos adversos graves. Se necesitan vectores más potentes que se dirijan al músculo.
La administración sistémica de AAV se ha utilizado para tratar a cientos de pacientes con atrofia muscular espinal, distrofia muscular de Duchenne (DMD, causada por mutaciones de pérdida de función en DMD) y miopatía miotubular (provocada por pérdida de mutaciones funcionales en MTM1). Aunque los primeros resultados son alentadores, los eventos adversos graves asociados con estos tratamientos, incluida la muerte de cuatro pacientes con miopatía miotubular y de uno con DMD, ocurrido en diciembre de 2021, han levantado voces de advertencia. La causa de las cuatro muertes en el ensayo de miopatía miotubular está bajo investigación y puede haber estado relacionada con cambios patológicos en el hígado que son exclusivos de ese trastorno. Aún no se han publicado detalles sobre la muerte del paciente con DMD. En todos estos trastornos, la expresión génica y la eficacia han sido subóptimas debido a los efectos tóxicos del hígado que limitan la dosis y, en algunos casos, a las respuestas inmunitarias contra el vector. En consecuencia, numerosos grupos han buscado desarrollar vectores AAV mejorados que puedan administrar genes al músculo en dosis más bajas y al mismo tiempo limitar la exposición al hígado.
Mohammadsharif Tabebordbar y colaboradores del Instituto Broad del MIT y Harvard (Estados Unidos) informaron recientemente sobre el desarrollo de vectores AAV modificados que se entregan a las células musculares en dosis comparativamente bajas y, al mismo tiempo, reducen la absorción hepática. Esto podría aumentar en gran medida las perspectivas de desarrollo de una terapia génica segura y eficaz en numerosos trastornos musculares.
Los vectores AAV tienen una estructura simple en la que docenas de copias de las proteínas de la cápside forman una cubierta que transmite un gen terapéutico. Se han encontrado cientos de serotipos de AAV naturales que difieren principalmente en la secuencia de las proteínas de su cápside. Estas variantes de la cápside dictan el tropismo de tejido y tipo celular de los vectores resultantes. Para generar vectores AAV con tropismo muscular, los autores desarrollaron un método de detección de alto rendimiento en ratones y macacos mediante el cual se generaron aleatoriamente millones de variantes de secuencia para crear una biblioteca de vectores AAV (figura 1). A continuación, estos se seleccionaron funcionalmente por su capacidad para acumularse en el músculo después de la administración intravascular. Todas las cápsides también se seleccionaron sobre la base de su capacidad para transducir las células de los miotubos primarios humanos. Las cápsides desarrolladas a partir de macacos fueron más consistentes con respecto a la eficacia que las variantes de ratones. Sorprendentemente, todas de AAV seleccionadas portaban el mismo motivo de aminoácidos de arginina-glicina-ácido aspártico (RGD), que se sabe que se une a miembros de la familia de proteínas de las integrinas.
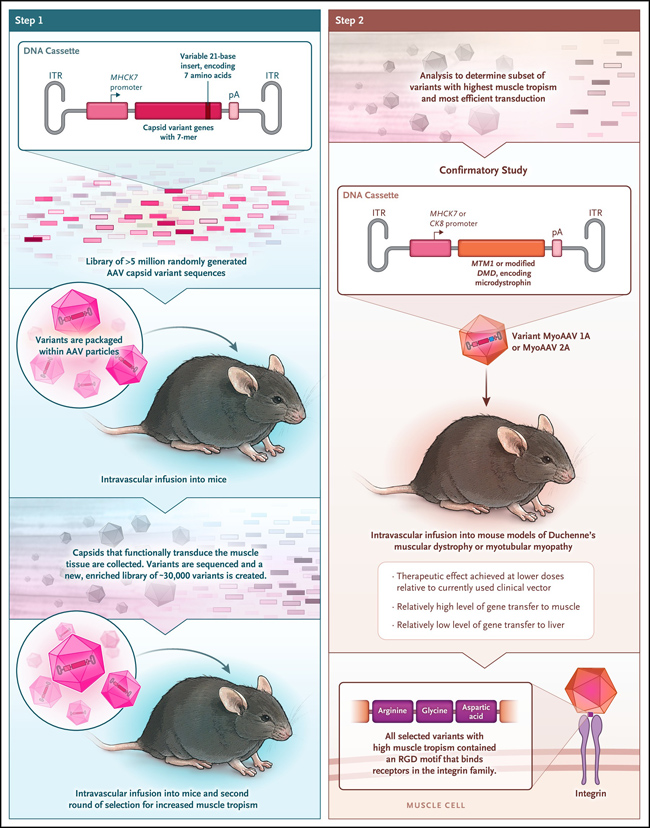
Figura 1: apuntando al músculo con nuevas variantes de AAV.
En un estudio liderado por M. Tabebordbar, se creó una biblioteca de millones de variantes del gen de la cápside del serotipo 9 del virus adenoasociado (AAV) para luego clonarlas en un casete de ADN que llevaba un promotor restringido al músculo (se muestra el promotor MHCK7, aunque luego usaron el promotor CK8) y un sitio de poliadenilación (un terminador de la transcripción). Luego, los casetes de ADN se empaquetaron en partículas de AAV y se infundieron en ratones o macacos. Se aislaron los vectores acumulados en el músculo y se determinó la secuencia de ADN de las variantes de la cápside enriquecidas en el músculo. Estas se volvieron a clonar en nuevos casetes de expresión, se introdujeron en una nueva biblioteca de AAV y se infundieron nuevamente en ratones o macacos para otra ronda de selección muscular. Las variantes más enriquecidas se probaron luego en modelos de ratón de miopatía miotubular o distrofia muscular de Duchenne con el uso de genes terapéuticos (MTM1 o DMD). Este enfoque produjo varias variantes nuevas de AAV que eran más eficientes en la entrega de genes al músculo y menos eficientes en la entrega de genes al hígado. ITR denota repetición terminal invertida y señal de poliadenilación pA.
El equipo de investigadores inicialmente utilizó un gen informador fácil de estudiar como "carga" en sus construcciones AAV y utilizó genes terapéuticos en estudios de confirmación. En dos ejemplos, analizaron genes que portaban MTM1 y DMD, que son muy similares a los de AAV utilizados actualmente en ensayos clínicos, y observaron eficacia en dosis que eran al menos 10 a 15 veces más bajas que las usadas actualmente en vectores clínicos. También se encontró que estos vectores reducen la transferencia de genes al hígado por un factor de 3.
Este planteamiento podría emplearse para producir portadores que se dirijan a muchos otros tejidos o para generar vectores adicionales orientados al músculo. Debido a que cada uno de los vectores con tropismo muscular descritos por los autores portaba el motivo de unión a integrina, el uso de esta unión o señalización parecería esencial para la transferencia génica eficiente a las células musculares. Esta conclusión se reforzó en un ensayo previo realizado por otro grupo que fue capaz de identificar vectores AAV con tropismo muscular. Todos portaban un motivo RGD.
Queda por ver si estas versiones de vectores AAV se traducirán en mejores resultados clínicos, pero las observaciones son alentadoras. Muchos portadores anteriores identificados a través de estudios en ratones no funcionaron en animales más grandes, pero los AAV más nuevos con tropismo muscular sí lo hacían en macacos. Estos pueden resolver los principales problemas que han provocado eventos adversos graves en la mayoría de los ensayos clínicos con DMD y atrofia muscular espinal que han utilizado vectores. Tales investigaciones se han asociado con efectos tóxicos transitorios de bajo nivel en el hígado que, aunque en gran parte manejables con el uso de glucocorticoides, limitan la dosis de AAV que se puede administrar de manera segura. De mayor preocupación son las observaciones de activación del complemento y trombocitopenia en algunos de los pacientes tratados. Los mecanismos involucrados en estos problemas aún se están explorando, pero la duda se ha centrado en las interacciones entre los anticuerpos y las proteínas de la cápside de AAV que pueden activar las vías del complemento. Aunque el equipo de Tabebordbar demostró que los nuevos AAV, similares a los AAV utilizados actualmente, son neutralizados por anticuerpos, su uso en dosis más bajas resultaría en una reducción de la activación del complemento.
Los estudios de escalada de dosis de los nuevos vectores no han mostrado algún efecto secundario tóxico o relacionado con el sistema inmunitario claro. En consecuencia, es probable que avancen en los ensayos clínicos. Si el perfil de los nuevos vectores en humanos es similar al de los macacos, este enfoque podría transformar las terapias genéticas actuales que involucran el músculo al tolerar el uso de dosis más bajas o quizás al permitir una mayor entrega de genes y eficacia en las dosis utilizadas hoy.
Fuente bibliográfica
A Boost for Muscle with Gene Therapy
Jeffrey S. Chamberlain, Ph.D.
Department of Neurology, University of Washington School of Medicine, Seattle.
N Engl J Med 2022; 386:1184-1186