La simplicidad en el mundo quiral
El último Premio Nobel de Química fue otorgado a Benjamin List y David MacMillan en reconocimiento a sus contribuciones a la síntesis de enantiómeros. Los descubrimientos han impactado a la farmacología y minimizando la contaminación ambiental.
El trabajo pionero de Louis Pasteur sobre la resolución del tartrato de amonio y sodio racémico en 1848 originó el concepto de quiralidad molecular. La mayoría de las biomoléculas son quirales, es decir, existen en formas de mano izquierda y derecha (enantiómeros) que son imágenes especulares no superponibles entre sí. El Premio Nobel de Química 2021, otorgado a Benjamin List y David MacMillan, reconoce la importancia de los enantiómeros y su síntesis.
Los receptores biológicos a menudo tienen una propensión a interactuar con solo una de las dos formas enantioméricas de moléculas quirales, como las que se encuentran en los fármacos quirales. Además, en algunos casos, los medicamentos enantioméricamente puros (es decir, los que contienen solo un enantiómero) tienen una potencia más alta que los fármacos racémicos y, por tanto, pueden administrarse en dosis más bajas. Además, la bioactividad deseada puede residir en un solo enantiómero; en muchos casos, un enantiómero muestra el efecto farmacológico deseado, mientras que el otro es perjudicial. Por ejemplo, la (S)-ketamina es un anestésico, mientras que la (R)-ketamina es un alucinógeno y la (R)-talidomida tiene efecto sedante, mientras que la (S)-talidomida es teratogénica (figura 1A). En la década de 1960, el descubrimiento de los diferentes efectos de estos enantiómeros aumentó la importancia de la quiralidad en el desarrollo de fármacos.
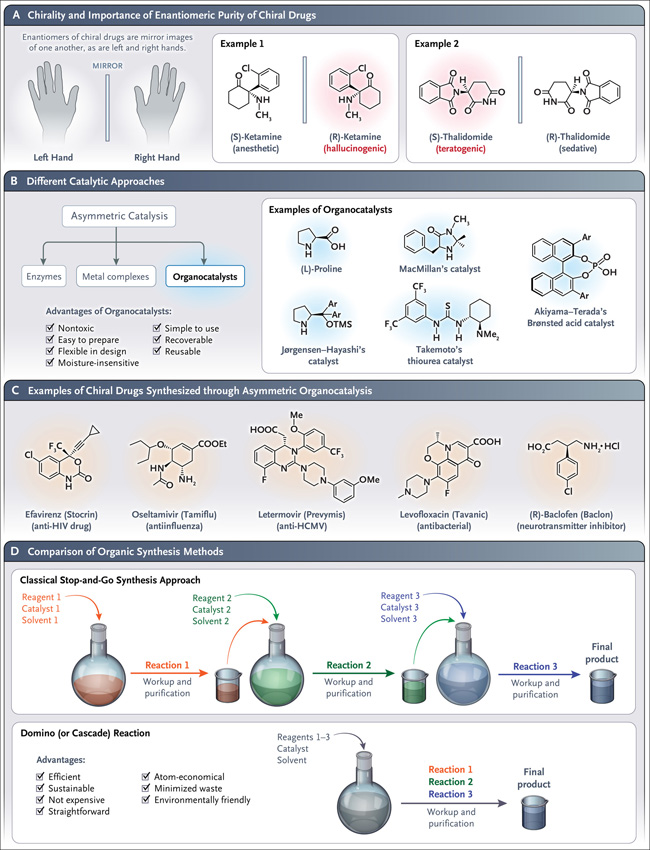
Figura 1: organocatálisis asimétrica en química verde y medicinal.
Muchas biomoléculas son quirales, es decir, existen como mano izquierda y derecha (enantiómeros) que son imágenes especulares no superponibles entre sí. Para muchos fármacos y moléculas de origen natural, la bioactividad deseada reside en un solo enantiómero (panel A). La organocatálisis asimétrica mediada por pequeñas moléculas orgánicas quirales (p. ej., L-prolina, imidazolidinona quiral, derivados de tiourea y ácidos de Brønsted) ha demostrado ser una herramienta limpia y respetuosa con el medio ambiente para la síntesis de moléculas enriquecidas enantioméricamente (panel B). Se conoce el potencial de los métodos organocatalíticos para la síntesis química libre de metales de fármacos quirales (panel C). El uso de reacciones organocatalizadas (en cascada) mejora la eficiencia de la síntesis de compuestos bioactivos y fármacos (panel D). HCMV denota citomegalovirus humano y VIH al virus de inmunodeficiencia humana.
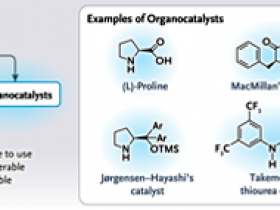
Uno de los mayores desafíos de la tecnología farmacéutica es la generación de fármacos enantioméricamente puros. Los químicos inventaron muchas estrategias exitosas para obtener tales compuestos mediante resolución quiral o catálisis asimétrica con enzimas o complejos metálicos catalíticos (figura 1B). List y MacMillan desarrollaron un método diferente, la organocatálisis asimétrica, para obtener compuestos quirales enantiopuros. La organocatálisis asimétrica utiliza pequeños catalizadores orgánicos (organocatalizadores) que son quirales, como derivados de aminoácidos, derivados de alcaloides, (tio) ureas y ácidos de Brønsted. La versatilidad sintética de los organocatalizadores es considerable y es una característica clave que ha contribuido a su éxito. Los organocatalizadores asimétricos simples, como la L-prolina y sus derivados, son imitadores de enzimas (figura 1B). De hecho, estos superan a las enzimas y los catalizadores metálicos y han permitido síntesis orgánicas más seguras, rentables y respetuosas con el medio ambiente.
En la síntesis catalítica asimétrica, los organocatalizadores quirales son más simples, más versátiles y fáciles de controlar que los catalizadores metálicos y los biocatalizadores. Los biocatalizadores requieren condiciones de reacción estrictas y, por lo general, tienen una pequeña cantidad de sustratos. Los catalizadores metálicos, por otro lado, son muy versátiles pero costosos y, a menudo tóxicos para las personas o el medio ambiente. Deben separarse del producto, porque incluso trazas de impurezas de metales en un medicamento pueden ser tóxicas. Además, el rendimiento de algunos catalizadores de metales de transición depende de la ausencia de exposición a la humedad o al aire, lo que los hace difíciles de usar y costosos en síntesis a gran escala.
Los organocatalizadores asimétricos se utilizan actualmente en la síntesis de sabores; fragancias productos naturales; moléculas biológicamente activas no naturales; y andamios medicinales. Su influencia en la química médica es evidente por su uso en la síntesis de agentes protectores contra el cáncer, antivirales, antiparasitarios, antibacterianos, neuroprotectores y cardiovasculares. Más específicamente, la organocatálisis asimétrica se usa para preparar, por ejemplo, el efavirenz, un medicamento para el tratamiento de la infección por el virus de la inmunodeficiencia humana; oseltamivir, un antiviral para tratar y prevenir la influenza A y la influenza B; letermovir, un antivírico altamente específico contra el citomegalovirus humano; levofloxacina, un fármaco antibacteriano; y (R) -baclofeno, un inhibidor de neurotransmisores (figura 1C).
Otro beneficio de los organocatalizadores es que las reacciones que catalizan pueden tener lugar en medios acuosos o en condiciones de flujo sin disolventes, lo que reduce el desperdicio y brinda oportunidades más ecológicas para la investigación industrial y académica. El desarrollo de organocatalizadores asimétricos activos redox (fotoorganocatalizadores), que se activan por la luz (un reactivo renovable, no peligroso y respetuoso con el medio ambiente) y organocatalizadores asimétricos reutilizables son económicos y medioambientalmente atractivos.
Además, el uso de organocatalizadores puede aumentar la eficiencia y el "verdor" de la fabricación de fármacos mediante reacciones "one-pot" y dominó (o cascada). Las reacciones tienen lugar sin la adición de más reactivos (figura 1D). Este eficaz método sintético hace que el aislamiento y la purificación de productos intermedios después de cada paso de reacción sean superfluos.
Reflexionando sobre el notable progreso posibilitado por los descubrimientos de List y MacMillan, se recuerda la expresión “vivir mejor a través de la química”, en donde lo mejor está por venir.
Fuente bibliográfica
A Noble Quest for Simplicity in the Chiral World
Svetlana B. Tsogoeva
Department of Chemistry and Pharmacy, Friedrich-Alexander University of Erlangen–Nürnberg, Erlangen, Germany.
10.1056/NEJMcibr2116228