El ADN como guardián inmunológico
Investigaciones revelan cómo nuestras células emplean el ADN como herramienta de defensa, activando respuestas inmunitarias para combatir infecciones y enfermedades, como las autoinmunes y el cáncer. Esto abre nuevas oportunidades para el desarrollo de fármacos innovadores.
El Premio Albert Lasker 2024 de Investigación Médica Básica fue otorgado a Zhijian Chen, del Centro Médico de la Universidad de Texas Southwestern en Dallas – EE. UU., en reconocimiento a sus destacados descubrimientos sobre cómo el ADN activa las respuestas inmunitarias.
El ADN es ampliamente reconocido como el material genético esencial, pero también puede ser un potente estimulador de la inflamación. Nuestras células detectan el ADN foráneo como un mecanismo para activar respuestas inmunitarias, como por ejemplo frente a virus de ADN. Estas respuestas implican la producción y secreción de interferones de tipo I, que son proteínas que coordinan la inmunidad antiviral. Ahora, se conoce que las respuestas al ADN desempeñan un papel fundamental en varias enfermedades, incluidas las autoinmunes y el cáncer. La contribución clave de Chen fue identificar una enzima llamada GMP-AMP sintasa cíclica (cGAS), la cual se activa al unirse al ADN y desencadena el proceso inflamatorio.
Las investigaciones que condujeron a este descubrimiento empezaron a finales de los años 1990, cuando se identificó que un receptor transmembrana para el ADN, llamado receptor tipo toll 9 (TLR9), actuaba en las células para iniciar respuestas inflamatorias tras unirse al ADN de fuentes extracelulares. Sin embargo, pronto se hizo evidente que el TLR9 no podía explicar completamente la capacidad del sistema inmunológico para activar la respuesta inflamatoria. En 2006, dos estudios importantes realizados en los laboratorios de Ruslan Medzhitov y Shizuo Akira demostraron que el ADN citosólico o intracelular también puede provocar respuestas de interferón independientemente del TLR9. Esto dio lugar a una intensa y desafiante búsqueda de siete años para identificar el sensor de ADN citosólico. Durante este tiempo, al menos media docena de sensores fueron anunciados en revistas de prestigio, solo para ser desacreditados más tarde.
Aunque en ese momento no era evidente, un avance clave resultó ser el descubrimiento de una potente proteína inductora de interferón que ahora se conoce como STING (estimulador de genes de interferón). Esta molécula fue descubierta por varios grupos de investigación, y cada uno le dio distintos nombres y funciones. Finalmente, Glen Barber y sus colegas proporcionaron pruebas genéticas de que STING era esencial para la respuesta de interferón al ADN intracelular, pero la identidad del sensor de ADN que actúa antes de STING y el mecanismo bioquímico de la activación de STING continuaron siendo un misterio.
Paralelamente, los bacteriólogos estudiaban cómo las células de mamíferos responden a las moléculas de señalización bacterianas llamadas dinucleótidos cíclicos. Estas moléculas, formadas por dos nucleótidos unidos en un bucle cerrado, fueron identificadas inicialmente en bacterias, donde actúan como segundos mensajeros regulando diversas funciones fisiológicas. Varios investigadores demostraron que estas moléculas bacterianas provocan respuestas de interferón en células de mamíferos. En 2011, Dara Burdette encontró que los dinucleótidos cíclicos estimulan la síntesis de interferones al actuar como agonistas que se unen directamente a STING.
Finalmente, en 2012 el equipo de Chen informó el descubrimiento de cGAS y su producto enzimático único. Esta enzima se activa al unirse al ADN, y combina GTP y ATP para formar un dinucleótido cíclico llamado GMP-AMP cíclico (cGAMP) (figura 1). A diferencia de los dinucleótidos cíclicos bacterianos, el cGAMP producido por cGAS presenta tanto un enlace fosfodiéster 3' a 5' convencional como un enlace fosfodiéster 2' a 5', poco común. Chen demostró que cGAMP se une a STING de manera similar a los dinucleótidos cíclicos bacterianos, activando así respuestas de interferón. Esto estableció una conexión entre la detección de ADN por cGAS, la señalización de STING y la inducción de interferón.
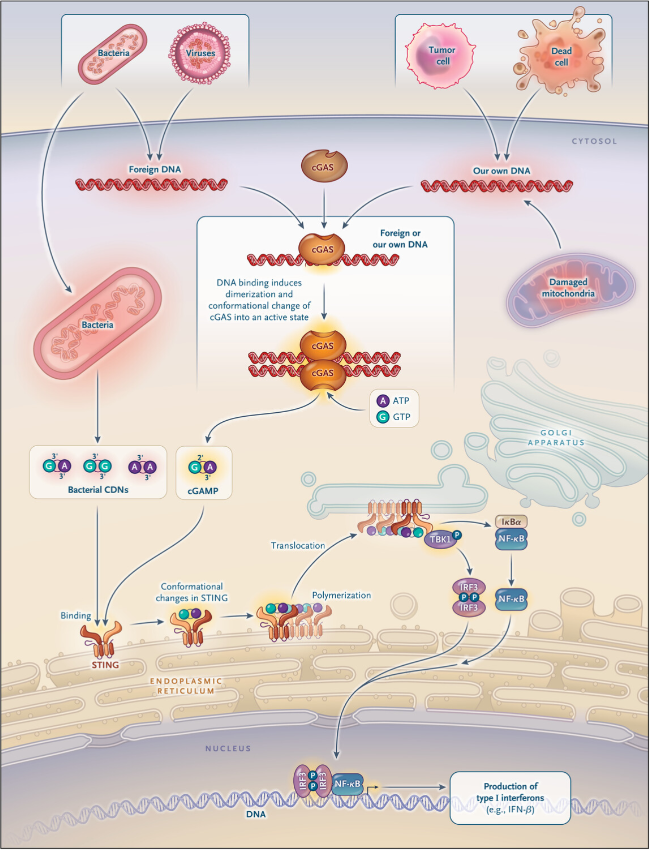
Figura 1: vía de detección de ADN cGAS-STING
Varios estudios posteriores confirmaron que cGAS es importante para la defensa contra virus y otros agentes infecciosos. Una pregunta fascinante, pero aún no totalmente resuelta, es cómo cGAS es capaz de responder al ADN patógeno sin ser activado por el abundante ADN presente naturalmente en nuestras células. Una hipótesis sugiere que el ADN patógeno se detecta en compartimentos como el citosol, mientras que nuestro ADN permanece de forma segura en el núcleo. En cualquier caso, está claro que nuestro propio ADN puede activar de forma aberrante el cGAS en muchos contextos biológicos, lo que indica que el papel de cGAS se extiende más allá de las infecciones. Ahora se sabe que las enfermedades genéticas raras, como el síndrome de Aicardi-Goutières, surgen de una acumulación patológica de ADN que induce un trastorno dependiente de cGAS. La pérdida de la integridad del ADN y la activación de cGAS también ocurren en células tumorales y pueden provocar inmunidad antitumoral. Incluso las enfermedades autoinmunes y el envejecimiento pueden implicar inflamación inducida por cGAS. Por lo tanto, cGAS ha surgido como un actor central en las respuestas inmunitarias, tanto protectoras como perjudiciales. Actualmente, la industria farmacéutica se centra en la vía cGAS-STING, desarrollando inhibidores para bloquear la autoinmunidad y agonistas para promover la inmunidad antitumoral.
El trabajo de Chen y colaboradores ha esclarecido cómo nuestras células detectan ADN foráneo o aberrante para proteger nuestro propio ADN. Un hallazgo particularmente sorprendente en esta área fue el descubrimiento de que proteínas similares a cGAS y STING también están presentes en bacterias, donde desempeñan un papel defensivo contra los virus que las infectan. Esto sugiere que el sistema cGAS-STING es una característica ancestral de nuestra biología, con orígenes que se remontan a más de mil millones de años.
Fuente bibliográfica
How DNA Sensing Drives Inflammation
Russell E. Vance, Ph.D.
Howard Hughes Medical Institute and the Department of Molecular and Cell Biology, University of California
DOI: 10.1056/NEJMcibr2410049