Células T para combatir el cáncer
Las células T autólogas modificadas se han utilizado con éxito para tratar tumores en una pequeña proporción de individuos. Un reciente estudio apunta a un potencial enfoque que permitiría tratar a más pacientes.
Los tumores humanos expresan antígenos, detectándose células T específicas para estos en personas con cáncer. Sin embargo, se sabe que las células T reactivas a tumores generalmente no funcionan o son ineficaces porque, a pesar de su presencia, a menudo el cáncer progresa y eventualmente causa la muerte. Una terapia para establecer una inmunidad antitumoral eficaz es la transferencia adoptiva de linfocitos: la administración de millones de células T reactivas a tumores, altamente funcionales y generadas in vitro a pacientes con cáncer. Las células T reactivas a tumores pueden aislarse de los propios tumores, estimularse y expandirse in vitro e infundirse nuevamente al paciente. Alternativamente, las células T autólogas se generan in vitro para volverse reactivas mediante la introducción de genes que codifican receptores específicos para antígenos tumorales (ya sean receptores de células T [TCR] o receptores de antígenos quiméricos [CAR]).
Aunque se han observado éxitos impresionantes con la transferencia adoptiva de células T en subgrupos de individuos oncológicos y en varios tipos de cáncer, la mayoría de estos, especialmente aquellos con tumores sólidos, todavía no tiene respuestas a largo plazo. ¿Por qué? Cuando las células T ingresan en los tumores, quedan expuestas al microambiente tumoral inmunosupresor y al antígeno tumoral persistente. Las señales microambientales, el encuentro persistente con el antígeno y la estimulación crónica del TCR llevan a las unidades T a un estado de hiporrespuesta, también conocido como agotamiento o disfunción de las células T. Éstas dejan de proliferar y pierden su capacidad de producir las citocinas efectoras (factor de necrosis tumoral α). [TNF-α], interferón-γ e interleucina-2) y moléculas citotóxicas (granzimas y perforina) que son necesarias para un ataque y eliminación de las células tumorales (figura 1).
¿Se pueden modificar las células T para que resistan tal disfunción? Una nueva investigación sugiere que sí. Los avances tecnológicos, incluidos el desarrollo de pantallas de perturbación de todo el genoma, permiten una disección de los mecanismos moleculares que regulan la disfunción de las células T inducida por tumores. Sin embargo, dichas pantallas se han limitado en gran medida a la pérdida de función que apunta a los reguladores negativos; más desafiantes son las pantallas de ganancia de función para la identificación de reguladores positivos de la función de las células T. El ensayo generó una pantalla de ganancia de función a escala del genoma en células T humanas primarias, descubriendo genes y vías que impulsan la proliferación de células T, la producción de citocinas efectoras y la eliminación de tumores in vitro (figura 1).
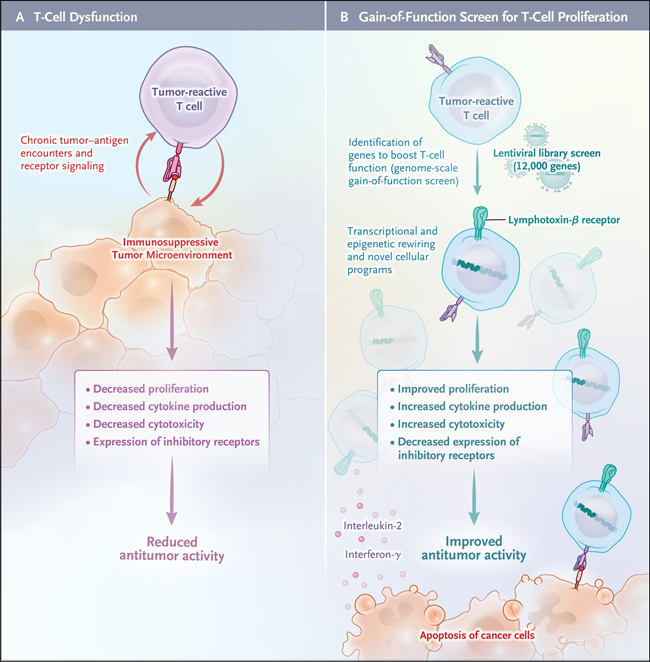
Figura 1: reprogramación de la célula T con eficacia terapéutica.
Las células T reactivas a los tumores dentro de los tumores en progresión se vuelven disfuncionales debido al encuentro persistente con el antígeno tumoral y la señalización crónica del receptor de células T (TCR) o el receptor de antígeno quimérico (CAR) y los factores inmunosupresores en el microambiente tumoral (panel A). Los linfocitos T disfuncionales no proliferan ni producen citocinas efectoras o moléculas citotóxicas, y expresan múltiples receptores inhibidores (p. ej., muerte programada 1 [PD-1] y antígeno 4 asociado a linfocitos T citotóxicos [CTLA4]). Los reguladores positivos de la función de las células T pueden identificarse mediante una plataforma de detección de ganancia de función a escala del genoma (panel B).
Se transdujeron células T humanas primarias de donantes sanos con una biblioteca lentiviral que contenía 12.000 genes con código de barras para determinar el efecto de cada gen en la proliferación de células T. La codificación de genes por barras implica la inclusión deliberada de una secuencia de ADN única y corta que puede considerarse como un marcador del gen que la acompaña. Es fácil de "leer" y, por lo tanto, es similar al uso de códigos de barras comúnmente conocido. Al secuenciar los códigos de barras en las células T más proliferativas, se pudieron identificar y clasificar genes candidatos que impulsan la proliferación de células T. Algunos de los genes codificaban reguladores conocidos de la proliferación de células T, pero sorprendentemente, el gen con el efecto más fuerte fue LTBR, que codifica la proteína receptora de linfotoxina-β (LTBR). Este receptor es un miembro de la familia de receptores TNF y normalmente se expresa en la superficie de las células de linajes epiteliales y mieloides, pero no en las células T.
¿Estos genes también mejorarían otros aspectos de la función de las células T, incluida la citotoxicidad y la secreción de interleucina-2 e interferón-γ? Lo hacían, y nuevamente se observó el efecto más fuerte con las células T que expresan LTBR. En una serie de experimentos posteriores, los autores analizaron cómo funcionaba LTBR en las células T. Desarrollaron una tecnología de secuenciación llamada OverCITE-seq, que permite la identificación del gen sobreexpresado y la captura simultánea de datos genéticos y moleculares granulares con resolución de una sola célula. En combinación con estudios epigenéticos y funcionales, OverCITE-seq reveló que LTBR induce un profundo recableado transcripcional y epigenético en todo el genoma, activa la vía del factor nuclear κB e impulsa varios factores de transcripción clave, incluido uno que se sabe que es fundamental para la autorrenovación y longevidad de las células T.
Luego, los investigadores probaron si la sobreexpresión de los genes mejor clasificados podría aumentar la función efectora antitumoral de las células CAR T. Expresaron LTBR junto con CAR dirigidos a CD19 en células T de donantes sanos y en células T de pacientes con linfoma difuso de células B grandes. Las células CAR T que expresan LTBR y se dirigen a CD19 de donantes sanos y pacientes mostraban una mayor funcionalidad y una citotoxicidad mejorada contra las células tumorales que expresan CD19 in vitro. Estos son hallazgos emocionantes. Una interrogante es si los genes como LTBR también podrían impulsar las células T in vivo, en modelos preclínicos y, lo que es más importante, en pacientes con cáncer, en quienes las células T están expuestas al antígeno tumoral y a la inmunosupresión microambiental durante semanas o incluso meses. Además, dado que estos genes impulsan la proliferación celular, ¿existe un mayor riesgo de inducir la transformación maligna de las células T? No obstante, este estudio, además de otros publicados recientemente sobre análisis de ganancia de función, destaca el poder de las plataformas de análisis a gran escala para la identificación de nuevos genes que mejoren las terapias celulares de próxima generación, incluso para el tratamiento de tumores sólidos, en donde las terapias que implican la transferencia celular adoptiva siguen siendo un desafío.
Fuente bibliográfica
Turbocharging the T Cell to Fight Cancer
Andrea Schietinger, Ph.D.
Immunology Program, Memorial Sloan Kettering Cancer Center, New York.
DOI: 10.1056/NEJMcibr2203616