Cáncer de mama y resistencia a medicamentos
Las mutaciones en un gen relacionado con HER2, un gen frecuentemente implicado en cánceres de mama y otras neoplasias malignas, pueden amplificar la actividad que estimula el crecimiento tumoral. Estos hallazgos explicarían por qué muchos pacientes con mutaciones en HER2 no responden a los inhibidores dirigidos a este impulsor oncológico y terminan requiriendo de otros tratamientos.
El receptor 2 del factor de crecimiento epidérmico humano (HER2), un receptor de tirosina quinasa, es un importante objetivo farmacológico y un biomarcador clínico en el tratamiento del cáncer mamario. Actualmente, la Administración de Alimentos y Medicamentos (FDA) ha aprobado ocho medicamentos dirigidos a HER2: tres anticuerpos monoclonales, dos conjugados anticuerpo-fármaco y tres inhibidores orales de tirosina quinasa. Un obstáculo importante para el tratamiento exitoso del cáncer, incluido el de mama, es el desarrollo de resistencia a los medicamentos por parte del cáncer. Por lo tanto, es de interés una reciente publicación de Ariella B. Hanker y colegas que promueve la existencia de un mecanismo de resistencia a los fármacos diseñados contra HER2.
Los cánceres de mama se diagnostican como HER2 positivo o HER2 negativo sobre la base de pruebas inmunohistoquímicas (que detectan la sobreexpresión de la proteína HER2) o hibridación fluorescente in situ (que detecta la amplificación del gen HER2). Normalmente, HER2 funciona como un correceptor con otros miembros de la familia HER, como el receptor 3 del factor de crecimiento epidérmico humano (HER3) o el receptor del factor de crecimiento epidérmico, y activa las vías de señalización, incluida la de la fosfatidilinositol 3-quinasa (PI3K) - vía AKT (figura 1A). Sin embargo, en el cáncer de mama HER2 positivo, su amplificación genera una sobreexpresión masiva de HER2, lo que da como resultado una señalización constitutiva e incontrolada, que impulsa el crecimiento del cáncer de mama.
Durante décadas, el tratamiento se ha limitado a pacientes con cáncer de mama HER2 positivo, porque los ensayos clínicos habían demostrado que con HER2 negativo no se beneficiaban de los medicamentos dirigidos a HER2. Sin embargo, hace aproximadamente 9 años, se identificaron mutaciones activadoras de HER2 (es decir, alteraciones dentro de HER2 que dan como resultado la señalización constitutiva de HER2) en cánceres de mama que considerados negativos para HER2 sobre la base de pruebas inmunohistoquímicas o hibridación in situ con fluorescencia. En 2004 se descubrieron mutaciones similares en HER2 en el cáncer de pulmón de células no pequeñas. El hallazgo de mutaciones en HER2 en 2 a 5% de las pacientes con cáncer de mama metastásico con receptor de estrógeno positivo y HER2 negativo generó inmediato interés. ¿Podrían los pacientes con mutaciones de HER2 beneficiarse de los fármacos dirigidos a HER2 aprobados por la FDA?
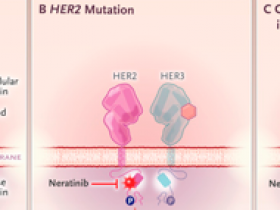
Se lanzaron tres ensayos clínicos con neratinib, un inhibidor de la tirosina quinasa oral de segunda generación, para evaluar esta posibilidad, ya que los datos preclínicos habían sugerido que podría ser un fármaco potente y eficaz en pacientes con cáncer de mama con mutación HER2 (figura 1B). La monoterapia con neratinib o su combinación con fulvestrant mostró beneficio clínico en 28 a 46% de las pacientes con mutación HER2, pero la mediana de supervivencia libre de progresión fue solo de 3,6 a 5,4 meses. Aunque este resultado fue impresionante dado que las participantes del ensayo tenían una condición metastásica y habían recibido muchos regímenes de tratamiento, tanto la resistencia a los medicamentos ya sea primaria o adquirida, limitaron el beneficio en cada uno de los ensayos.
En su estudio, los autores identificaron mutaciones concurrentes en HER2 y HER3 en cánceres humanos que aumentaban la actividad de HER2 y HER3 y disminuían la capacidad de respuesta a la selección de HER2 (figura 1C). Utilizaron datos genómicos del Proyecto GENIE de la Asociación Estadounidense para la Investigación del Cáncer, junto con información genómica de un laboratorio comercial, para estudiar las mutaciones de HER3 y PIK3CA en cánceres de mama con mutación de HER2. Descubrieron que las primeras mutaciones no coexistían, un hallazgo que es consistente con que HER3 y PIK3CA estén en la misma vía. Dado que el dímero HER2-HER3 es un potente activador de la vía PI3K-AKT, ellos plantearon la hipótesis de que las mutaciones concurrentes en HER2 y HER3 mejorarían la activación de PI3K-AKT. Se utilizaron simulaciones por computadora de la estructura de la proteína para predecir si HER3 mutante pudiera activar a HER2 mutante. Estas simulaciones aceleraron enormemente la investigación porque el dominio de la quinasa HER2 es difícil de cristalizar y probablemente no habría sido factible estudiar el efecto de múltiples mutaciones de HER2 con la tradicional cristalografía de proteínas.
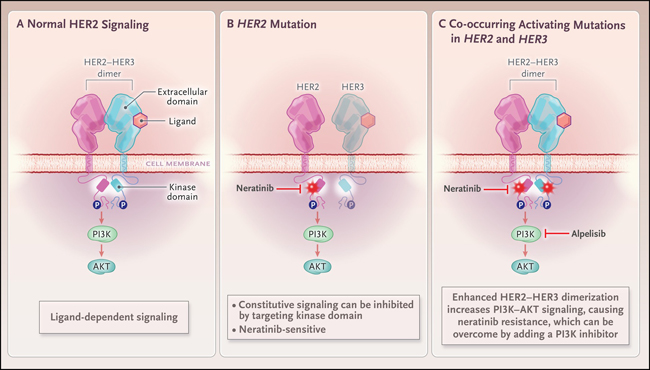
Figura 1: resistencia a la inhibición de la tirosina quinasa HER2.
La señalización de la quinasa del receptor 2 del factor de crecimiento epidérmico humano (HER2) se activa mediante la unión del ligando al receptor 3 del factor de crecimiento epidérmico humano (HER3) en células normales (panel A). La presencia de una mutación activadora en el gen HER2 conduce a la señalización constitutiva y al crecimiento tumoral, que es sensible al efecto del inhibidor de la tirosina quinasa neratinib (panel B). Sin embargo, las mutaciones concurrentes en HER3 mejoran la dimerización entre HER2 y HER3, lo que conduce a un aumento de la fosfatidilinositol 3-quinasa (PI3K), señalización de AKT y resistencia a neratinib, que aumenta mediante la adición de un inhibidor de PI3K, como alpelisib (panel C).
Finalmente, los investigadores llevaron a cabo experimentos con líneas celulares y un xenoinjerto derivado de muestras obtenidas de pacientes con mutación HER2 para probar una predicción basada en datos de simulaciones por computadora: que la combinación de medicamentos de neratinib y un inhibidor de PI3K alfa (utilizaron alpelisib) inhibiría el crecimiento de células cancerosas. Encontraron sinergia entre estos dos medicamentos aprobados por la FDA, avalando futuros ensayos al respecto.
Este estudio muestra la utilidad de analizar datos genómicos y simulaciones por computadora para generar hipótesis, indicando también que las mutaciones en HER3 potencialmente causan resistencia a fármacos como neratinib en pacientes con cáncer de mama con mutación en HER2. El ensayo clínico SUMMIT respalda esta conclusión: las pacientes con mutaciones concurrentes de HER2 y HER3 tuvieron respuestas deficientes al tratamiento con neratinib.
Estos hallazgos también pueden ser relevantes para otros cánceres con mutación HER2, incluido el de pulmón de células no pequeñas, los cánceres del tracto gastrointestinal y los ginecológicos. Además, debido a que HER3 juega un papel central en el cáncer de mama amplificado por HER2, el presente estudio sugiere que, en este contexto, HER3 mutante también podría impulsar la resistencia a fármacos primaria o adquirida Se necesita más investigación en esta área.
Fuente bibliográfica
Breast Cancer, HER2 Mutations, and Overcoming Drug Resistance
R. Bose and C.X. Ma
Division of Oncology, Department of Medicine, and the Siteman Cancer Center, Washington University School of Medicine, St. Louis.
N Engl J Med 2021; 385:1241-1243