Nanopartículas para disolver los trombos
La obstrucción de los vasos sanguíneos debido a una trombosis o embolia es una de las principales causad de muerte en el mundo. Hoy en día, los pacientes con embolia pulmonar, derrames cerebrales, ataques cardíacos y otros tipos de trombosis aguda que provocan casi la completa oclusión vascular, son tratados con dosis sistémicas de poderosos medicamentos para disolver los coágulos. Debido a que estos fármacos pueden causar con frecuencia hemorragias graves y mortales, ya que circulan libremente por todo el cuerpo, el tamaño de las dosis dadas a algún individuo se ve limitado porque la eficacia debe ser equilibrada con los riesgos.
Desintegración de los coágulos sanguíneos
Los medicamentos fibrinolíticos "rompecoágulos" se administran a pacientes que han sufrido un ataque al corazón o un accidente cerebrovascular isquémico. Éstos deben administrarse sistémicamente de forma local a través de un catéter colocado dentro del vaso obstruido. Un reciente estudio realizado por Netanel Korin y colaboradores (Science 2012; 337:738-42) concluyó que si el activador tisular del plasminógeno (t-PA) se introduce en la “nanoterapéutica activada por esfuerzo de fricción” (SA-NT), se puede distribuir el fármaco donde más se necesita. Los resultados de sus investigaciones con modelos de ratón para la trombosis arterial aguda y embolia pulmonar sugieren que la dosis total administrada puede ser reducida por un factor de 100, en comparación con la entrega por vía intravenosa de t-PA. Los beneficios potenciales asociados con este enfoque son una reperfusión más rápida, disminución de hemorragia e inicio más temprano de la terapia fibrinolítica.
No es nueva la idea que las fuerzas del fluido y, en particular, el “esfuerzo de corte” (fricción, o la fuerza tangencial por unidad de área ejercida por la sangre que fluye) pueden modular la velocidad de disolución del coágulo. Los enfoques que han utilizado placas paralelas en cámaras de flujo y de perfusión humana ya sea con sangre o plasma que contienen un fármaco fibrinolítico sobre coágulos de fibrina, han demostrado que la tasa de disolución del coágulo aumenta con una mayor fuerza de fricción. Esta mejora se debe al aumento de transferencia y reposición de la droga en la superficie frontal del coágulo, a la permeación a través de la malla de fibrina del coágulo y al desgarro mecánico de su estructura tridimensional. Teniendo en cuenta los enormes beneficios clínicos y riesgos asociados a fármacos fibrinolíticos, se ha mantenido hasta hoy la evaluación de la relación entre el flujo y la disolución del coágulo. El grupo de N. Korin ha obtenido buenos resultados con las características únicas del campo de flujo estenótico.
Las SA-NT son agregados plaquetarios que se autoensamblan a nanopartículas hidrófobas, y tienen un diámetro medio de 200 nm. Los experimentos con un reómetro y cámaras de microfluidos demuestran que son estables bajo un estrés normal de fricción arterial pero se desagregan a altas presiones de fricción que son típicas de la estenosis arterial. La superficie de las nanopartículas se recubre con t-PA para tener unidades bioquímicamente activas, el t-PA se une por conjugación con el uso de estreptavidina-biotina. Con este nuevo diseño, las SA-NT secuestran más t-PA a medida que pasan a través de la vasculatura normal, pero cuando se encuentran bajo una gran presión de fricción patológicamente alta, se rompen, liberando más dosis de t-PA a nivel local. El aumento de tensión (≥ 100 dyn X cm-2) se produce en el máximo de cualquier estenosis arterial clínicamente significativa, así, el uso de SA-NT libera t-PA sólo donde se necesita, justo en la estenosis máxima, permitiendo que el t-PA se una a un trombo en crecimiento o ateroma ulcerado (fig. 1). Otra característica se relaciona con la mecánica de fluidos en el arrastre de partículas: debido a su diámetro más grande, las SA-NT intactas tienen altas fuerzas de fricción que impiden la unión a coágulos de la pared, mientras que las nanopartículas liberadas por la mayor fuerza de fricción están sujetas a fuerzas de arrastre mucho más bajas, generando la unión a la fibrina. La concentración de SA-NT también se produce cerca de la pared del vaso (un efecto llamado "marginación") debido al movimiento de eritrocitos y a la deformabilidad por la fricción arterial. En el estudio de N. Korin y colegas, los grupos de control experimental incluyeron nanopartículas recubiertas pero no agregadas, que eran tan efectivas como el t-PA soluble; lo que demuestra que la activación de la fricción es crítica para el éxito de las SA-NT.
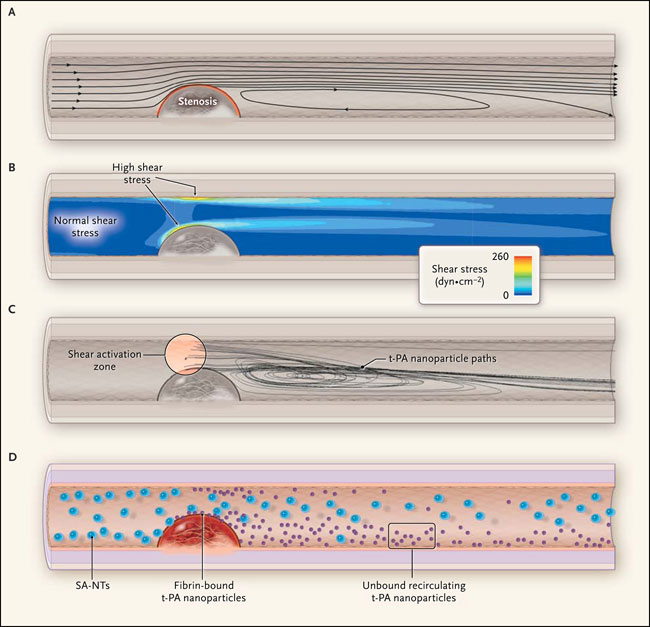
La fibrinolisis dependiente de SA-NT se logra aprovechando las características de flujo de una estenosis arterial. El panel A muestra la estenosis debido a un coágulo parcialmente oclusivo, ateroma, o ambos. El flujo se limita a lo largo de la superficie de la estenosis, lo que conduce a un flujo de alta velocidad, a gradientes cerca del vértice de la estenosis y una disminución de la recirculación detrás de la estenosis. El Panel B grafica que el estrés de fricción de fluidos (que se muestra en una sección transversal de un vaso sanguíneo) es normal adelante de la estenosis (10 a 20 dyn X cm-2), aumentando patológicamente la presión (> 100 dyn X cm-2) cerca de la pared arterial en el vértice de la estenosis. El panel C señala una vista tridimensional de la región de activación de la fricción y vías de las nanopartículas; las nanopartículas que no se unen son barridas en la zona de recirculación postestenótica. El panel D observa las SA-NT tipo plaquetas que permanecen intactas y liberan un mínimo de t-PA bajo condiciones arteriales normales pero se descomponen debido a la alta tensión de fricción cerca de la superficie de la estenosis, liberando elevadas concentraciones de nanopartículas recubiertas de t-PA que pueden adherirse a la fibrina en un trombo, activar el plasminógeno en plasmina y disolver el coágulo.
Se realizará mucha investigación antes que el valor clínico de las SA-NT pueda ser conocido, incluyendo los mecanismos de limpieza y farmacocinética, y las pruebas en seres humanos. Afortunadamente, los principales constituyentes, el ácido poliláctico-co-glicólico y el t-PA, poseen largos historiales clínicos, pero los productos químicos utilizados para la conjugación de nanopartícula-t-PA (biotina y estreptavidina) podrían provocar una respuesta inmune. Además, también se carece de datos para el riesgo de hemorragia. Se acepta que la hemodinámica regula la velocidad de la hemostasia y el tipo de coágulo formado: las plaquetas se activan y se agregan en la sangre que fluye localmente, incluso durante unos pocos milisegundos, generando un esfuerzo de fricción anormalmente alto. Esta agregación es independiente de fibrinógeno y, por lo tanto, las SA-NT recubiertas con t-PA no tendrán efecto sobre las plaquetas. Además, los mecanismos moleculares de adhesión y agregación de plaquetas a la pared del vaso lesionado varían en función de la tensión de fricción local; las bajas de flujo estimulan la formación de trombos ricos en fibrina, mientras que el flujo arterial genera trombos ricos en plaquetas. Cuando se administra durante la lesión de la pared arterial, las SA-NT retrasan significativamente el tiempo de oclusión en comparación con las no SA-NT, probablemente debido a que después de la ruptura, éstas consiguen la máxima concentración de fármaco en el trombo en desarrollo. Sin embargo, el trombo arterial (rico en plaquetas) se vuelve resistente a la lisis debido a la retracción del coágulo por inducción plaquetaria y al inhibidor del activador del plasminógeno. La eficiencia de las SA-NT recubiertas de t-PA disminuye significativamente con el tiempo después de la formación de un trombo arterial, confirmando la ventana de tiempo crítico en el que fármacos fibrinolíticos tienen que ser administrados para ser más efectivos.
Los hallazgos recientes con las SA-NT motivan a los ingenieros biomédicos para que desarrollen nuevos agentes de este tipo. Dos objetivos son el desarrollo de SA-NT antitrombóticas o fibrinolíticas profilácticas que permanezcan en circulación durante días o semanas en pacientes con alto riesgo de trombosis, y de SA-NT antiproliferativas o antiinflamatorias que frenen o reviertan el crecimiento de lesiones ateroscleróticas.
Fuente bibliográfica
The Shear Stress of Busting Blood Clots
David M. Wootton, Ph.D., and B. Rita Alevriadou, Ph.D.
Department of Mechanical Engineering and the Maurice Kanbar Center for Biomedical Engineering, the Cooper Union for the Advancement of Science and Art, New York (D.M.W.); and the Departments of Biomedical Engineering and Internal Medicine (Cardiovascular Medicine) and the Dorothy M. Davis Heart and Lung Research Institute, Ohio State University, Columbus (B.R.A.).
DOI: 10.1056/NEJMcibr1207994