Leishmania
Parásito parasitado
Los miembros del género Leishmania infectan muchos vertebrados, incluyendo a humanos, perros y roedores. Los ciclos de vida implican un hospedador (por ejemplo, el ser humano) y un vector (la mosca de arena) que transmite el parásito. En el vector, el parásito adquiere una forma característica morfológica conocida como promastigote, y se reproduce asexualmente en el intestino del vector. Cuando el vector muerde al vertebrado, los promastigotes se internan en el organismo. Los promastigotes entran en las células y cambian a la forma denominada amastigote. El amastigote se reproduce en las células del hospedador, y cuando la célula muere finalmente los amastigotes se liberan e infectan otras células.
Hay diferentes tipos afecciones causadas por Leishmania. En algunas, los amastigotes no se extienden más allá del sitio de la picadura del vector. Esto resulta en una leishmaniasis cutánea, que a menudo se cura espontáneamente. En otros casos, se pueden diseminar a los órganos viscerales (hígado, bazo), dando lugar a la leishmaniasis visceral o a las membranas mucosas de la boca y la nariz, lo que lleva a la leishmaniasis mucocutánea. Si no se tratan, pueden producir altas tasas de mortalidad.
Gravedad de la leishmaniasis mucocutánea
Alertar al hospedador de una infección es un paso crítico en el desarrollo de una respuesta inmune, y la identificación de las moléculas patógenas ha preocupado a los inmunólogos durante más de 20 años. Un reciente estudio realizado por Annette Ives y colaboradores (Science 2011; 331:775-778) señala que la infección del parásito protozoario Leishmania con un virus endógeno aumenta la respuesta inmune, lo cual podría ser no tan bueno para el paciente.
La leishmaniasis es causada por diferentes especies de protozoos parásitos intracelulares, y es frecuente en el sur de Europa, el Medio Oriente, India, algunas partes de África, América Central y del Sur. La infección puede producir una enfermedad visceral y potencialmente mortal o una lesión cutánea que se cura con el tiempo. Sin embargo, el daño cutáneo a menudo no se resuelve rápidamente y se propaga a otros sitios. En América del Sur, una forma particularmente grave de la condición, llamada leishmaniasis mucocutánea, se desarrolla después de la resolución de una lesión primaria en un pequeño número de personas. Paradójicamente, tal efecto no proviene de una respuesta inmune débil sino que se debe a una respuesta inflamatoria que conduce a una infiltración masiva de células inflamatorias. Esto infiltración genera una destrucción severa de la mucosa nasofaríngea, a pesar de la reducción efectiva del número de parásitos. En la actualidad, no hay manera de predecir cuándo se dará o iniciará la forma más severa de la infección.
Los especímenes de Leishmania invaden los macrófagos y se multiplican dentro de un compartimiento endosomal. Los receptores tipo Toll (TLR) - receptores de reconocimiento de patrones específicos que detectan los organismos infecciosos en una fase temprana de la infección - cubren la superficie de las células y los compartimentos de la línea endosomal, y tienen la oportunidad de interactuar con el parásito en cualquier sitio. Para determinar si la leishmaniasis mucocutánea derivada de Leishmania guyanensis activaba de forma diferencial a macrófagos, el grupo de A. Ives infectó a macrófagos con clones que promovían metástasis y con clones que no lo hacían. Sus resultados fueron notorios, los clones que generaban metástasis inducían niveles mucho más altos de citocinas proinflamatorias y quimiocinas en comparación al otro grupo. Mediante el uso de ratones mutantes para TLR, los autores demostraron que esta respuesta depende de la presencia de un producto del gen TLR 3 (TLR3) localizado en los endosomas que reconoce la doble cadena de ARN, y su proteínas, y el dominio del receptor de la interleucina 1 tipo Toll conteniendo el adaptador de la inducción del interferón beta (TRIF). Consciente que algunos parásitos Leishmania de América del Sur contienen un virus ARN de doble cadena (LRV1), descrito por primera vez hace casi 20 años, los autores se preguntaron si la presencia del virus influía las respuestas de los macrófagos inducidas por el parásito. De forma importante, los clones promovedores de metástasis tenían niveles más altos de LRV1 y su ARN de doble cadena sólo generaban altos niveles de citoquinas inflamatorias, por lo tanto, este hallazgo apoyaba la hipótesis que los parásitos LRV1 podrían aumentar la enfermedad a través de vías dependientes de TLR3 en un subgrupo de pacientes con leishmaniasis mucocutánea (figura 1).
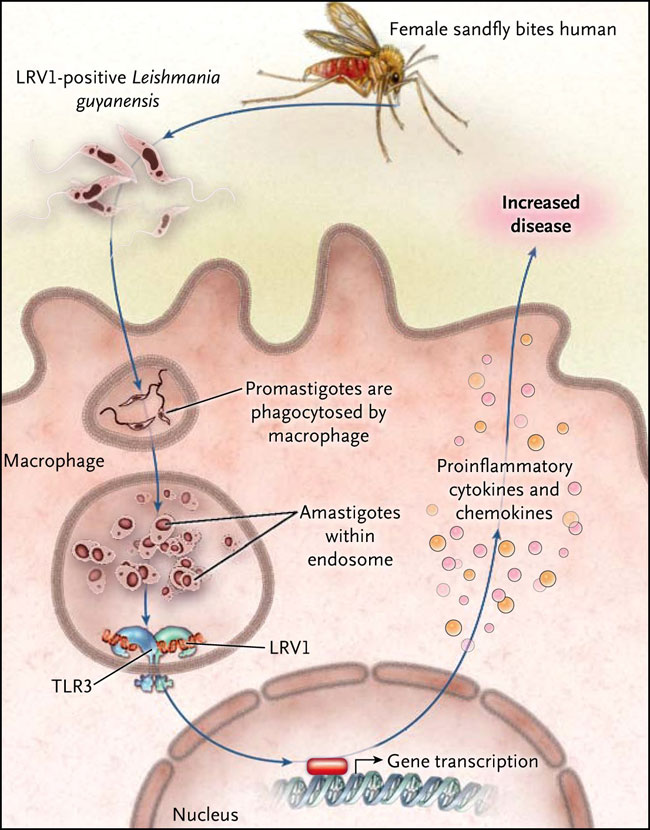
El parásito Leishmania se transmite al mamífero por un mosquito. Una vez inoculados en la piel, los parásitos en estado de promastigote infectan a macrófagos y se transforman a la forma amastigote. Viven y se dividen dentro de un compartimento endosomal del macrófago. El presente estudio demuestra que algunos parásitos contienen un virus de ARN, llamados LRV1, que promueve la producción de moléculas proinflamatorias como el factor de necrosis tumoral alfa, interleucina-6, CXCL10 y CCL5. La respuesta al virus está mediada por el producto del gen TLR 3 (TLR3), un receptor de ARN que se expresa en el mismo compartimiento endosomal de los parásitos. Los autores plantearon la hipótesis que el ARN viral es liberado por los parásitos muertos poco después de la infección, la unión del ARN viral a TLR3 resulta en la producción de citocinas y quimiocinas que aumentan la respuesta inflamatoria y por tanto exacerban la enfermedad.
Entonces, ¿cómo el virus puede intervenir la patogenia de la leishmaniasis? Obviamente, una mayor respuesta inmune que normalmente se asocia con la separación eficiente de los parásitos y menos enfermedad. Sin embargo, en la leishmaniasis mucocutánea, la respuesta inmune no es regulada una vez que los parásitos están controlados, lo que agrava la patología. La hipótesis es que la presencia del virus mantiene una respuesta inmune activa, dando lugar a condiciones inmunopatológicas severas. La activación de los macrófagos es poco probable que sea completamente dependiente de la presencia de este virus, ya que las moléculas de Leishmania se unen por lo menos a cinco diferentes TLR. Sin embargo, los datos presentados en esta investigación sugieren que LRV1 en gran medida puede amplificar las respuestas de los macrófagos después de la interacción con los parásitos. Cómo este efecto promueve la metástasis aún no se ha determinado.
Hasta la fecha, la distribución de cepas de Leishmania que contienen LRV1 se ha limitado a determinadas regiones de América del Sur, y un gran número de cepas deben ser evaluadas para apoyar la hipótesis que aquellas que contienen el virus se asocian con el desarrollo posterior de leishmaniasis mucocutánea. Además, es importante determinar si el virus influencia la infección primaria por Leishmania. Por ejemplo, poco después de la infección con L. braziliensis, algunos pacientes tienen una respuesta inmunitaria exagerada que se manifiesta por dramáticas linfoadenopatías antes del desarrollo de la lesión cutánea. ¿Podría este tipo de respuesta deberse a la presencia de LRV1, y promover la difusión temprana del parásito? Por último, si la presencia de LRV1 está vinculada a una mayor incidencia de enfermedades graves inducidas por Leishmania, el cribado para el virus se convertiría en una parte importante del diagnóstico. En la actualidad, el estándar de cuidado en Brasil para la leishmaniasis cutánea es el tratamiento con antimonio pentavalente. Sin embargo, otras terapias disponibles, tales como la anfotericina liposomal, pueden ser más eficaces. Si la hipótesis de los autores se confirma, los pacientes infectados con cepas de Leishmania que contienen LRV1 se podrían tratar más agresivamente en el momento del diagnóstico para prevenir el desarrollo de la enfermedad mucocutánea.
Fuente bibliográfica
Leishmania — A Parasitized Parasite
Phillip Scott, Ph.D.
School of Veterinary Medicine, University of Pennsylvania, Philadelphia
N Engl J Med 2011; 364:1773-1774