Cardiología
Periostina y falla cardíaca
La insuficiencia cardíaca crónica se trata principalmente con beta bloqueadores, inhibidores de la enzima convertidora de la angiotensina y receptores bloqueadores Tipo 1 de la angiotensina II para poder reducir la excesiva carga al corazón causada por la activación del sistema nervioso simpático y el sistema renina-angiotensina. Sin embargo, sólo el 20% y el 30% de los pacientes con insuficiencia cardíaca crónica responden a estos agentes. Ya que la recuperación de la vida en los individuos con insuficiencia cardíaca crónica es todavía deficiente, un tratamiento efectivo es definitivamente necesario.
Los recientes avances en biología molecular y celular han podido identificar algunos importantes mecanismos de la falla cardíaca. Como resultado, se ha observado que el gen de la periostina se encuentra altamente expresado en los modelos de insuficiencia cardíaca. La periostina fue previamente obtenida de una línea celular osteoblástica de ratón y se sabe que se expresa en el hueso y, en menor medida, en pulmón, pero no en otros tejidos. El gen codifica una proteína integrada por 838 aminoácidos y tiene una típica secuencia de señal, seguida de un dominio rico en cisteína y un dominio C terminal. Hasta ahora, no se han descubierto en plenitud las reales funciones fisiológicas de la periostina, con la excepción de que puede modular la nueva formación ósea y la adhesión celular.
Por otra parte, también se ha observado que dicha molécula promueve el crecimiento metastásico del cáncer de colon al activar elementos señalizadores que estimulan la supervivencia celular, identificándola entonces como una diana terapéutica potencial para el control de la neoplasia. El cáncer de colon y recto normalmente metastatiza en el ámbito hepático y como ocurre con la mayoría de los cánceres, es la metástasis y no el tumor primario, el responsable de la mortalidad. Cuando la proteína es introducida en las células del cáncer de colon y recto humano cultivadas en laboratorio, éstas presentan una mayor tendencia a la propagación a nivel hepático al introducirse después en un modelo experimental animal. Las investigaciones han demostrado que el mecanismo molecular subyacente para la metástasis de tumores mediada por la periostina tiene relación con un aumento en la supervivencia del cáncer y de las células de los vasos sanguíneos en condiciones de estrés.
Pero las últimas investigaciones dirigidas por el Dr. Bernhard Kuhn sugieren un novedoso mecanismo para el tratamiento de un infarto coronario. El grupo del Dr. Kuhn en el Massachusetts General Hospital y la Escuela de Medicina Mount Sinai ha demostrado gran interés en la periostina, la cual está presente tanto en el desarrollo cardíaco así como en el daño miocárdico. Está todavía por verse si estas investigaciones se pueden traducir como una intervención segura y efectiva en pacientes humanos después del infarto de miocardio o en el contexto de la falla cardíaca de cualquier etiología. Sin embargo, los autores esperan que la proliferación estimulante de cardiomiocitos endógenos con periostina, derivados de periostina o miméticos pueda proveer un método novedoso para inducir reparo miocárdico.
Periostina: reparación, regeneración y recuperación del miocardio
La terapia de reperfusión temprana en el infarto de miocardio ha transformado el tratamiento de esta enfermedad. La restauración del flujo sanguíneo al corazón pocas horas después de la obstrucción coronaria trombótica reduce el tamaño del infarto, mantiene la función cardíaca y minimiza el riesgo de la insuficiencia cardíaca y de las arritmias mortales. Sin embargo, los altos índices de éxito de la reperfusión coronaria, junto con los esfuerzos para acortar el tiempo de la manifestación sintomática a la restauración del flujo de sangre arterial, nos ha acercado a los límites prácticos del manejo de revascularización aguda para el infarto de miocardio.
El trabajo reciente de Bernhard Kuhn y colaboradores (Nat Med 2007; 13:962-9) recalca el efecto de los acontecimientos celulares y moleculares postinfarto en la remodelación cardíaca adversa y en la insuficiencia cardíaca. La comprensión de estos acontecimientos puede conducir a nuevas estrategias para mejorar los resultados que ofrezcan una ventana terapéutica de semanas y no de horas.
Poco después del infarto, los cardiomiocitos muertos o seriamente dañados, son eliminados por la fagocitosis o el deceso celular programado (apoptosis) y son substituidos por fibroblastos intersticiales migratorios. Los fibroblastos generan una densa matriz extracelular de colágeno que, como cualquier cicatriz nueva, requiere una robusta vasculatura. Concomitantemente, los cardiomiocitos sobrevivientes, los cuales están terminalmente diferenciados y por lo tanto no son capaces de proliferar, sufren una hipertrofia patológica para poder compensar el tejido contráctil perdido. Cuando la escarificación es insuficiente, como en los pacientes bajo tratamiento a largo plazo con glucocorticoides, la presión intraventricular puede colapsar la integridad estructural del miocardio dañado, causando ruptura ventricular que suele ser potencialmente mortal. Por lo tanto, una herida cardíaca apropiadamente cicatrizada después del infarto es primordial para la supervivencia, para minimizar los resultados adversos y para el remodelado.
La remodelación ocurrida semanas o meses después del infarto es el resultado de la dilatación de la cavidad ventricular, con hipertrofia patológica y fibrosis del miocardio no infartado, lo que deteriora mucho más la función del corazón. Mecánicamente, la cicatriz del miocardio no contraído ejerce una presión biomecánica en el miocardio viable circundante, que a su vez responde liberando neurohormonas y citoquinas que estimulan la apoptosis de los cardiomiocitos y el reemplazo de la fibrosis. Estos acontecimientos y procesos celulares son iguales a los que son esenciales para sanar el infarto. La meta, por lo tanto, es apoyar el manejo curativo del infarto local y limitar la remodelación generalizada del miocardio. Con este fin, la regeneración del miocardio normal, por medio de la transformación indiferenciada de las células madre precursoras en cardiomiocitos y en células vasculares o por medio de poder forzar la proliferación de cardiomiocitos diferenciados y de vasos sanguíneos, se ha convertido en el “santo grial” de la reparación cardíaca.
Los cardiomiocitos adultos están seriamente limitados en su capacidad de proliferación. De hecho, sólo un puñado de células miocárdicas en un millón es capaz de realizar la síntesis del ADN nuclear, y puesto que los cardiomiocitos adultos típicamente poseen dos núcleos, el grado a el cual las divisiones nucleares puedan producir nuevas unidades es realmente desconocido. Sin embargo, observaciones de incrementos dramáticos en la síntesis de ADN del cardiomiocito después de producida la lesión del miocardio sugieren que la proliferación puede estar condicionalmente inducida. El grupo de Kuhn intentó comprobar esto mediante un factor implicado en muchos cánceres.
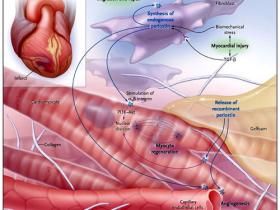
Los eventos celulares dominantes que dan lugar a un cáncer son la mayor proliferación de células y de tejidos, acompañados por la angiogénesis, los mismos procesos críticos necesarios para la regeneración del miocardio. B. Kuhn examinó los efectos de la periostina (una proteína implicada en la supervivencia y angiogénesis celular que es secretada por muchos tumores humanos) en la reparación cardíaca. Él y colegas observaron que una forma recombinante y truncada de la proteína aumentaba la síntesis de ADN en los cardiomiocitos adultos mediante la estimulación de las integrinas y la activación de la vía de la fosfatidilinositol-3-quinasa-proteína quinasa B. La inyección de periostina en corazones normales de rata aumentó la presencia de citoquinas y de marcadores de la síntesis de ADN de los cardiomiocitos, confirmando los resultados in vitro. La aplicación a largo plazo de periostina en corazones de ratas aquejadas de infarto más el uso de Gelfoam saturado adosado al epicardio no afectó el tamaño a corto plazo del infarto ni deterioró la cicatrización sino que realzó el funcionamiento contráctil y mejoró la remodelación cardíaca después de 12 semanas, mientras que disminuía la fibrosis miocárdica y la hipertrofia del cardiomiocito. Los corazones tratados con periostina también presentaron capas capilares más densas, sugiriendo el aumento de la angiogénesis del miocardio (figura 1).
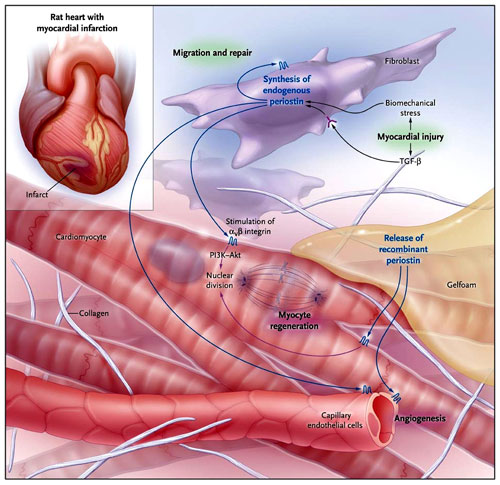
Un estudio reciente de Kuhn y colaboradores sugiere que el uso de periostina puede potenciar la reparación cardíaca después de un infarto de miocardio. La producción endógena de la proteína por los fibroblastos del miocardio es estimulada por la lesión cardíaca y promueve su cura mediante la activación de las integrinas alfa-vB1, alfa-vB3 o alfa-vB5 en miocitos y células del endotelio vascular. La liberación a largo plazo de periostina recombinante a través de un parche de Gelfoam en el epicardio fue capaz de estimular las mismas vías que promueven la regeneración y la angiogenesis del cardiomiocito, reduciendo al mínimo la remodelación. TGF-B denota el factor de crecimiento transformante beta y PI3K-Akt, la fosfatidilinositol-3-quinasa-proteína quinasa B.
La periostina normalmente es secretada por los fibroblastos cardíacos en respuesta a lesión del miocardio, y obra recíprocamente con los receptores de la integrina en las células diana para modular la remodelación celular de la matriz del corazón (figura 1). De momento, aumenta fuertemente el potencial clínico para las formas recombinantes de la periostina u otros factores con perfiles similares de actividad para mejorar la reparación y la regeneración cardíaca.
Los datos descritos por Kuhn y colaboradores no establecen una relación causal entre la proliferación de los cardiomiocitos estimulada por la periostina y el control de la remodelación cardíaca después del infarto de miocardio, ni está claro que la división nuclear en los cardiomiocitos de lugar a la producción de nuevos cardiomiocitos. Además, la prevención de la fibrosis y de la hipertrofia no es necesariamente un efecto primario de la periostina recombinante sino que podría ser un subproducto de la mejora global del estado hemodinámico del corazón. De hecho, paradójicamente los ratones “knock out” para el gen de la periostina demuestran una menor fibrosis y una mejor función cardíaca, con respecto a los animales controles, después del infarto al miocardio. Nace la necesidad de realizar más estudio que puedan clarificar estas interrogantes. Mientras tanto, el uso clínico de periostina o de terapias conceptualmente similares que apunten a la remodelación cardíaca postinfarto sigue siendo una perspectiva emocionante.
Fuente bibliográfica
Periostina and Myocardial Repair, Regeneration, and Recovery
Gerald W. Dorn, II, M.D.
Center for Molecular Cardiovascular Research, University of Cincinnati, Cincinnati, USA.
N Engl J Med. 2007 Oct 11;357(15):1552-4